Identificazione unica del dispositivo (UDI)
Servizi
Home / Etichettatura UDI
Etichettatura UDI
Il 24 settembre 2013, l'ente statunitense FDA (Food and Drug Administration) ha pubblicato una norma definitiva in base alla quale la maggior parte dei dispositivi medicali distribuiti negli Stati Uniti deve riportare un identificativo unico del dispositivo (UDI, Unique Device Identifier). Il sistema UDI facilita l'identificazione dei dispositivi medicali, la loro tracciabilità e individuazione durante la distribuzione e l'uso. In base alla norma le informazioni di prodotto relative ai dispositivi devono essere inoltrate al database globale di identificazione unica del dispositivo (GUDID) dell'FDA.
La norma impone anche l'apposizione della data con un nuovo formato standard su tutte le etichette dei dispositivi medicali.
Masimo ha aggiornato le etichette in conformità alla normativa UDI e agli standard GS1.
In caso di domande non contemplate nelle presenti domande frequenti, contattare il Servizio clienti:
USA: customerorders@masimo.com
Paesi extra USA: emeasales@masimo.com
Domande frequenti
Domande frequenti
1. Che cosa è l'UDI?
L'identificativo unico del dispositivo, o UDI (Unique Device Identifier), è una serie di caratteri numerici o alfanumerici basata su uno standard di codifica internazionale che identifica adeguatamente un dispositivo in fase di distribuzione e in fase di uso. L'UDI è composto da:
- Un identificativo del dispositivo, il GTIN (Global Trade Item Number): parte fissa e obbligatoria dell'UDI che identifica la versione specifica o il modello del dispositivo e l'emittente dell'etichetta del dispositivo stesso;
- Un identificativo di produzione: parte soggetta a condizioni e variabile dell'UDI che identifica uno o più degli elementi seguenti, se inclusa nell'etichetta del dispositivo:
- il lotto di produzione cui appartiene il dispositivo;
- il numero di serie di uno specifico dispositivo;
- la data di scadenza di uno specifico dispositivo; e/o
- la data in cui uno specifico dispositivo è stato fabbricato.
Masimo si serve di GS1 come agenzia abilitata per l'assegnazione di codici a barre e di strutture di codici a barre.
Si noti che i prodotti NON classificati come dispositivi medicali non hanno l'obbligo di contenere un codice a barre.
2. Chi deve uniformarsi alle normative UDI?
Tutte le case produttrici di dispositivi medicali devono uniformarsi alle normative UDI.
3. Qual è il calendario di attuazione per la conformità alle normative UDI?
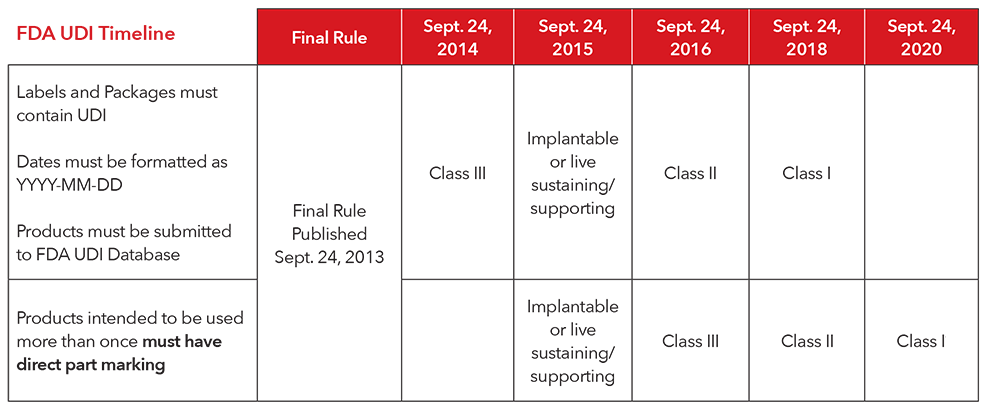
** Masimo esegue volontariamente la marcatura diretta di tutti i prodotti riutilizzabili. I prodotti Masimo non sono soggetti alla marcatura diretta secondo le attuali regole FDA.
4. In che modo Masimo si uniformerà ai requisiti UDI?
Masimo distribuisce prodotti di Classe II e pochi prodotti di Classe I. Masimo ha aggiornato le etichette in conformità alla normativa UDI e agli standard GS1.
Si noti che i prodotti NON classificati come dispositivi medicali non hanno l'obbligo di contenere un codice a barre.
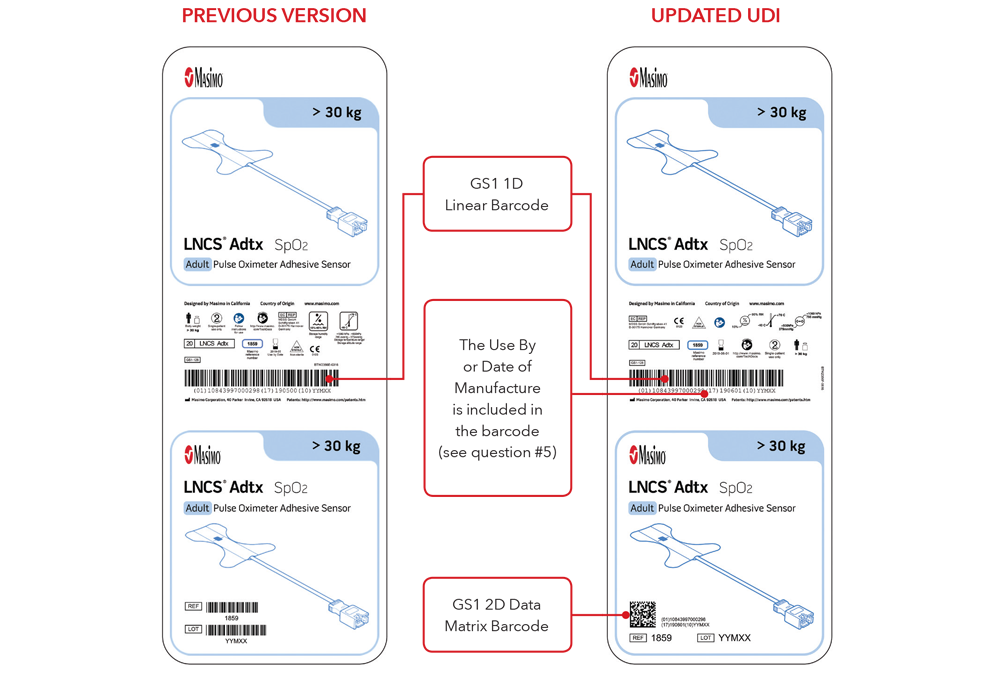
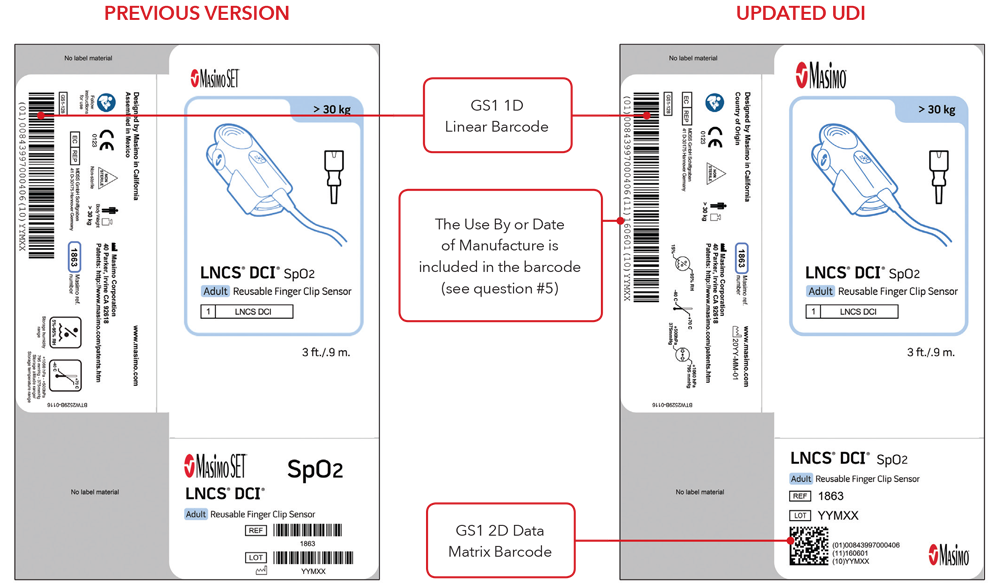
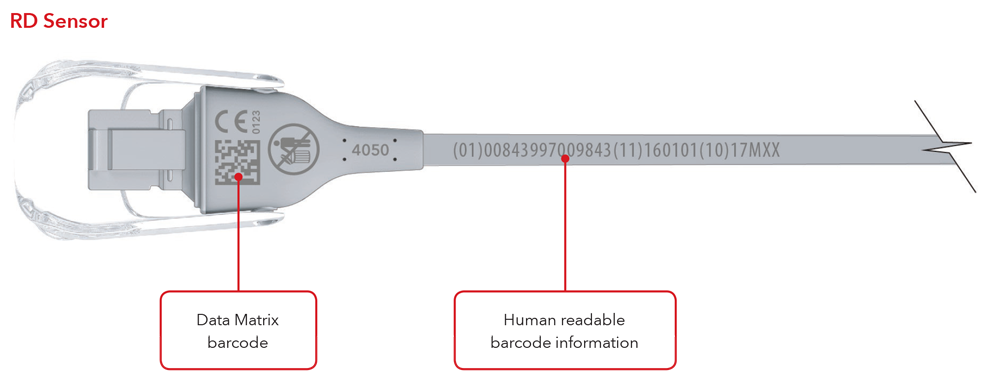
5. Che aspetto avranno l'etichetta UDI e la marcatura diretta del prodotto?
Di seguito sono riportati alcuni esempi di:
- Versione precedente e versione UDI aggiornata delle etichette delle scatole di sensori
- Sensore con marcatura diretta del prodotto
- Cavo con marcatura diretta del prodotto
Si noti che: a seconda del tipo di prodotto, l'etichetta contiene una delle due date. Per i prodotti con data "Da utilizzare entro", l'indicazione AAAA-MM-GG figurerà sotto il simbolo di scadenza e verrà anche codificata come AAMMGG dopo la produzione identificata (17) nei codici a barre GS1 e 2D. Per i prodotti senza data "Da utilizzare entro", la data di fabbricazione figurerà come AAAA-MM-GG accanto al simbolo della data di fabbricazione e verrà anche codificata come AAMMGG dopo l'identificativo di produzione (11) nei codici a barre GS1 e 2D.
Esempi di etichette delle scatole di sensori
Esempi per sensore e cavo con marcatura diretta del prodotto
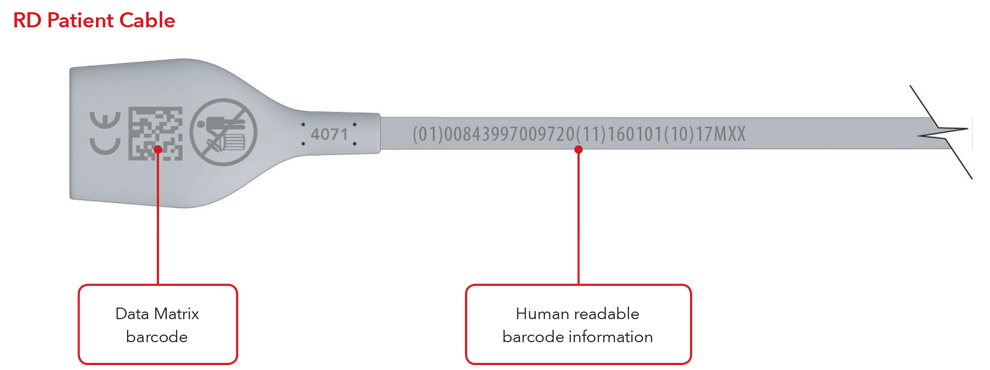
6. Che cosa è il Global Trade Item Number (GTIN)?
Il GTIN è un numero di identificazione GS1 univoco internazionale utilizzato per identificare un prodotto ("trade item"). I GTIN sono assegnati dal proprietario del marchio (emittente dell'etichetta) del prodotto e sono utilizzati per identificare i prodotti lungo la filiera globale fino all'utilizzatore finale, ad esempio un ospedale. Se un'azienda non si serve ancora del sistema GS1 con numeri GTIN per gestire i suoi prodotti, dovrà richiedere i GTIN per i prodotti che acquista.
Per ulteriori informazioni sui numeri GTIN, contattare GS1 all'indirizzo: https://www.gs1us.org/resources/standards.
7. Come si richiedono i GTIN dei prodotti?
Inviare una e-mail al Servizio clienti Masimo:
USA: customerorders@masimo.com
Paesi extra USA: emeasales@masimo.com
Includere nell'e-mail il proprio ID cliente e i numeri di parte dei prodotti.
8. Al momento i codici a barre LOT e/o REF Masimo riportati sull'etichetta vengono inseriti o acquisiti mediante scansione. Ci saranno grossi cambiamenti?
Sì. I codici a barre LOT o REF sull'etichetta verranno rimossi e sostituiti con testo e non potranno più essere acquisiti mediante scansione. Per le informazioni LOT, sarà necessario eseguire la scansione del codice a barre GS1 o individuarlo accanto al simbolo LOT sull'etichetta. Le informazioni REF sono identificabili nel GTIN corrispondente. Per ulteriori informazioni sui GTIN, vedere la domanda n. 6 in alto.
9. I numeri di prodotto Masimo cambieranno in seguito all'implementazione delle etichette UDI?
No, i numeri di prodotto Masimo resteranno invariati.
10. Qual è il nuovo formato standard per la data e quando entrerà in vigore?
La norma UDI ha adottato il formato standard per la data AAAA-MM-GG sulle etichette dei dispositivi. Le date indicate sulle etichette dovranno rispettare il nuovo formato a partire dalla data in cui l'etichetta del dispositivo deve riportare un UDI. Per ulteriori informazioni sul calendario di attuazione, vedere la domanda n. 3 in alto.
11. Masimo fornirà informazioni sui prodotti online?
Il GUDID è un database pubblico consultabile che contiene la parte di identificazione dispositivo (DI) dell'UDI di tutti i dispositivi medicali, oltre ad altre informazioni sui prodotti obbligatorie. Tutte le case produttrici di dispositivi medicali devono fornire le informazioni DI al GUDID. Masimo ha iniziato a fornire i dati al GUDID e si accerterà che tutti i prodotti vi vengano inseriti in corrispondenza o prima delle date previste dal calendario di attuazione dell'UDI.
12. Quali sono le conseguenze per le scorte esistenti? I fabbricanti devono marcarle di nuovo?
No, vi sono due eccezioni per le scorte esistenti:
- I dispositivi messi in commercio prima della data di conformità applicabile non hanno l'obbligo di uniformarsi alla norma definitiva.
- Anche i dispositivi fabbricati ed etichettati prima della data di conformità applicabile non hanno l'obbligo di conformità. Questa eccezione, tuttavia, scade 3 anni dopo la data di conformità applicabile.
13. È necessario che tutti i dispositivi vengano marcati direttamente con il rispettivo UDI?
No. La norma richiede la marcatura diretta solo per dispositivi medicali riutilizzabili che devono essere rigenerati (pulizia approfondita/sterilizzazione) prima del riutilizzo.
Masimo esegue volontariamente la marcatura diretta di tutti i prodotti riutilizzabili. I prodotti Masimo non sono soggetti alla marcatura diretta secondo le attuali regole FDA. Per ulteriori informazioni sul calendario di attuazione della marcatura diretta, vedere la domanda n. 3 in alto.
Per ulteriori informazioni sul sistema UDI, visitare la pagina relativa sul sito Web dell'FDA:
http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/UniqueDeviceIdentification/
Per ulteriori domande sul modo in cui Masimo intende uniformarsi alle normative UDI, contattare il Servizio clienti Masimo ai seguenti indirizzi:
USA: customerorders@masimo.com
Paesi extra USA: emeasales@masimo.com
PLCO-001927/PLMM-10045C-0818